Modul Praktikum Fisika Dasar II
HUKUM BOYLE-GAY LUSSAC
I. TUJUAN
1. Memahami prinsip Hukum Boyle-Gay Lussac.
2. Membuktikan berlakunya Hukum Boyle-Gay Lussac.
3. Mencari tetapan umum gas ideal.
II. DASAR TEORI
Pada proses isobarik, tekanan gas tetap, sedangkan volume dan temperatur gas berubah. Demikian juga dalam proses isokhorik dan isotermal, terdapat satu variabel atau besaran gas yang berada dalam keadaan tetap, sedangkan kedua variabel gas lainnya berubah. Bagaimanakah jika ketiga besaran yang menyatakan keadaan gas tersebut (tekanan, volume, dan suhu) berubah.
Dari ketiga hubungan antara tekanan, volume, dan suhu gas yang didapatkan dari Hukum Boyle dan Hukum Gay-Lussac dapat diturunkan suatu persamaan yang disebut persamaan keadaan gas ideal. Secara matematis, persamaan keadaan gas ideal dinyatakan dengan persamaan.
.....(2)
Oleh karena setiap proses yang dilakukan pada gas berada dalam ruang tertutup, jumlah molekul gas yang terdapat di dalam ruang tersebut dapat ditentukan sebagai jumlah mol gas (n) yang jumlahnya selalu tetap. Anda tentu sudah mengetahui bahwa mol adalah suatu besaran yang digunakan untuk menyatakan massa suatu zat dalam gram yang besarnya sama dengan jumlah molekul zat tersebut. Dengan demikian, persamaan keadaan gas ideal dapat dituliskan menjadi
.....(3)
dengan: n = jumlah mol gas,
R = tetapan umum gas = 8,31 × 103 J/kmolK (SI) = 8,31 J/molK,
p = tekanan (N/m2),
V = volume (m3), dan
T = temperatur (K).
Dari definisi mol zat yang menyatakan bahwa n = m / Mr . Persamaan (3) dapat dituliskan menjadi
.....(4)
Anda telah mempelajari bahwa massa jenis suatu zat adalah perbandingan antara massa dengan volume zat tersebut. Oleh karena itu, dari Persamaan (4) dapat diperoleh persamaan massa jenis gas.
.....(5)
Menurut prinsip Avogadro, satu mol gas mengandung jumlah molekul gas yang sama. Jumlah molekul gas ini dinyatakan dengan bilangan Avogadro (NA) yang besarnya sama dengan 6,02 × 1023 molekul/mol. Dengan demikian, Persamaan (4) dapat dinyatakan menjadi
 .....(6)
.....(6)
dengan: N = Banyak partikel gas, dan
NA = Bilangan avogadro = 6,02 × 1023 molekul/mol
Oleh karena nilai pada Persamaan (6) merupakan suatu nilai tetapan yang disebut konstanta Boltzmann, k, di mana k = 1,38 × 10–23 J/K maka persamaan keadaan gas ideal dapat juga dituliskan menjadi persamaan berikut.
......(7)
......(7)
======================================================
III. METODE PERCOBAAN
Alat dan Bahan
Prosedur Percobaan
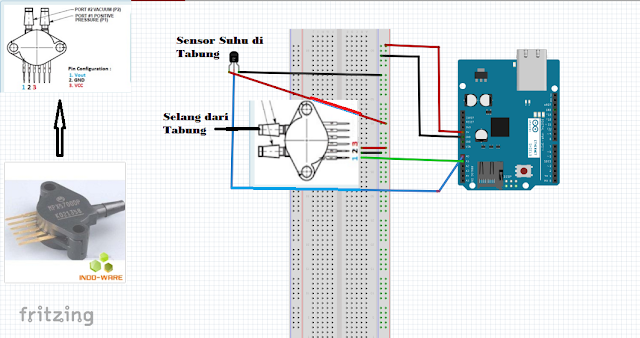 |
Skema Rangkaian Rederhana Praktikum |
- Menyusun alat-alat yang diperlukan seperti gambar di atas.
- Membuka Program yang sudah tersedia di Software Processing, kemudian Run.
- Variasikan volume sebanyak tiga kali, analisis perubahan tekanan gas (P), suhu gas (T), dan nilai tetapan umum gas ideal (R).
- Klik save data satu kali pada software processing untuk menyalin data ke notepad, kemudian klik satu kali lagi untuk menyimpan data notepad ke computer.”setiap variasi volume”.
- Klik save grafik satu kali pada software processing untuk menyalin grafik ke type PNG, kemudian klik satu kali lagi untuk menyimpan gambar grafik ke computer. .”setiap variasi volume”.
- Variasikan suhu dalam tabung sebanyak tiga kali dengan volume tetap menggunakan kompor listrik. Analisis perubahan tekanan gas (P), suhu gas (T), dan nilai tetapan umum gas ideal (R).
- Lakukan langkah 4 dan 5 untuk setiap variasi suhu.
- Klik Exit pada software Processing untuk mengahiri percobaan.
IV. TUGAS PENDAHULUAN
- Jelaskan asumsi yang digunakan dalam teori kinetic gas ideal !
- Jika anda memasak air dipantai dan digunung, manakah yang lebih cepat ? Jelaskan !
- Jelaskan Hukum Boyle-Gay Lussac !
- Apa yang dimaksud proses isobaric, isokhorik dan isothermal ? Jelaskan !
V. TUGAS AKHIR
1. Buktikan secara percobaan, berlakunya Hukum Boyle-Gay Lussac !
2. Factor apa saja yang mempengaruhi hasil percobaan anda !
3. Tentukan mol gas dalam botol berdasarkan persamaan (3). !
4. Hitung secara manual untuk memperoleh nilai tetapan umum gas (R), bandingkan, dan analisis dengan hasil percobaan. !
5. Buat grafik untuk proses isobaric, isokhorik dan isothermal ? Jelaskan !
VI. DAFTAR PUSTAKA
1. Serway, R. “Physics for scientist & Engineers With Modern Physics”, James Madison University Harrison burg, Virginia, 1989.
2. Resnick & Haliday, “ Fisika Jilid 1 ” Bab 20 Erlangga (Terjemahan).
3. Tipler, P. ”Fisika Untuk Sains dan Teknik Jilid 1” Erlangga (Terjemahan).


























terimakasih, sangat membantu
ReplyDelete